A korábbi részek:
Az RNS-ekről és a fehérjék gyártásáról
Jelen részre is igaz, és további megjegyzések nélkül az ezt követőkre is igaz lesz, hogy ez a cikk nem tudományos publikáció. Sok részletet „nagyvonalúan” kezelek, mert elsősorban megértetés a szándékom, és ez nem egy szakirányú egyetemi kurzus. Mivel az előző részre sokan panaszolták, hogy túl bonyolult és hosszú, próbálok egyszerűsíteni, mert azt szeretném, hogy az olvasók megértsék – különben nem olvassák el, és akkor csak magamban beszélek, azt pedig más hülyék is tudnak. Tehát: miért is az RNS?
A sejtek, függetlenül attól, hogy egysejtek-e, vagy egy soksejtű lény alkotórészei, nemcsak folyton-folyvást osztódnak, szaporodnak (főleg nem), hanem a köztes időben egyszerűen csak élnek, meg nőnek. Ezért örökítőanyaguk élettevékenységük nagyobb részében (kivéve az éppen logaritmikus szaporodási szakban lévő bacitenyészeteket) nem kettőződik. Ez azonban nem jelenti azt, hogy nyugiban lenne, éppen ellenkezőleg: veszettül másolják, hogy a benne rögzített tervrajzok alapján fehérjék készüljenek.
Ami egy nyúlban igazán fontos, a nagy metszőfogai ásványi anyagát kivéve, de minden más élőlényre igaz, az fehérje (különben a fog és a csont kompozitok, ásványi anyagiak mellett fehérjét tartalmaznak). Izomkötegeinket, belső szerveink struktúráját, kötőszöveteinket fehérjék építik fel. Fehérjék immunanyagaink nagy része, és valamennyi enzimünk, amelyek életműködésünket végzik, amelyek mindent gyártanak nekünk, ami nem fehérje (lipideket, szénhidrátokat, foszfatidokat, hormonokat stb.). Már a középiskolában is tanítják (azt is...), hogy a fehérjék aminosavakból állnak (azt már nem, hogy ezekhez más vegyületek is kapcsolódhatnak és módosulhatnak), és hogy ezeknek a fehérjéknek a „tervrajza” maga a DNS. Ahhoz azonban, hogy a DNS-en tárolt információból előbb-utóbb fehérje legyen, valakinek ezt az információt el kell vinnie a fehérjegyárba, valakinek oda kell talicskázni az aminosavakat, és valakinek ezt az információt le is kell fordítania fehérjére. Lehetőleg fordítani, nem ferdíteni, hogy működjön is. Az nem engedhető meg, mint ami az egyik németországi BMW gyárban történt, hogy két lengyel melós műszak előtt alaposan bespanglizott, és mosolyogva, de ötletszerűen rakták össze a kocsikat. Bár lehet, hogy az indexeket világszerte így szerelik a bömbikbe. Na, ezt csinálják az RNS-ek, azaz a DNS-hez hasonló ribonukleinsavak.
A többsejtűekben az eddig ismert (!) RNS-ek mind egyszálúak és lineálisak. Az információkat a DNS-ről a fehérjeszintézist végző sejtszervekbe, az ún. riboszómákba az m (Messenger) RNS-ek viszik. A genetikai kódot átfordító és az aminosavakat a fehérjeszintézishez odaemelő RNS-ek a t (transzfer) RNS-ek, azok az RNS-ek akik pedig a riboszómákban teljesítenek szolgálatot, és ténylegesen összepakolnak minket, az r (azaz: riboszóma) RNS-ek. Nem ez a három fajta van, mert vannak enzimként dolgozók és előanyag RNS-ek (sn, sc-RNS.ek) meg még egy pár féle, de ők kisbetűvel vannak szedve a stáblistán.
Honnan tudja a sejt, illetve a DNS, meg az enzimek, hogy a k.rva hosszú DNS-ről éppen speciel mégis mit, mennyit és miért kell másolni? Na, ez egy nagyon is helyénvaló kérdés, és mikor a jó öreg Peter Karlson írta azt a biokémiakönyvet, amiből én a kilencvenes évek elején először tanultam biokémiát, nagyjából még senkinek se volt róla meleg fingja se. Ma már ezt jórészt tudják, ez egy elképesztően hosszú és érdekes rendszer. A lényege, hogy a DNS-ről csak az a rész íródik át, aminek kell, oszt« passz.
A vírusok genetikai anyaga elképesztően tömörített, ahhoz képest az MP3 fájlformátum veszettül pazarlás. Sokszor, sőt, jellemzően ugyanaz a szekvencia több fehérjét is kódol más-más olvasási keretben. Ahogy abban a szóban , hogy „rigolya” benne van két madár, meg egy vénkisasszonyos világlátás is. Ez szükségszerű, mert a vírus pici, és különösen egy RNS vírus nem is lehet túl hosszadalmas (erről majd más részben). A baktériumok DNS-e is lényegre törő, abban kevés fehérjét nem kódoló (többek között ún. ARE) szakasz van, de a magasabb rendűek szekvenciájának magas százaléka nem kódol semmiféle fehérjét. Hogy mennyi? Kérem, pl. a humán genom 90%-a nem jelent fehérjét. Durva, nem? A biokémikusokat régről foglalkoztatja az értelmetlen szekvenciaszakasz, leginkább azért, mert az értelmes tök unalmas.
Ahogy nőből se túl nagy kihívás az, amelyik olyan, mint a Titanic (csak hozzávetőlegesen tudjuk, hányan voltak rajta, de több ezren), vagy több f.szt fogott, mint én kilincset, úgy ezek a szakaszok érdekesek, mert az biztosan állathatjuk, hogy nem feleslegesek. (Egyébként az eukariótákban is van olyan, hogy egy szekvencia több fehérjét is kódol, ez az ún. alternatív splicing, ez is egy jó buktató tétel szigorlaton..)
A DNS-ünk egy bizonyos része egyszerűen „kikapcsolt gén”. Ez tök ugyanolyan, mint mikor a lusta villanyász csak kiköti a szekrényből valamelyik áramkört, de a kábelt meg a többit nem bontják vissza. Marha sok ilyen van, mert az evolúció során számos tulajdonság feleségessé vagy legalábbis kevésbé fontossá vált, pl. az ember, szemben kétéltű-őseinkkel, nem fejleszt úszóhártyát, de teremtő atyánk úgy van vele, jól jöhet még az, majd egyszer, máskor visszakapcsoljuk. Mondjuk, a delfin se növesztett ismét kopoltyút, de a fene se tudja. Ha belenézünk a tükörbe, egy nagymértékben módosult, erősen specializált majmot látunk (már aki...) sokkal kisebb szemfogakkal, mint pl. a mandrilnak van, jóval kevésbé szőrös mellkassal (már aki...), mint egy orángutánnak, satöbbi. A legtöbb génnek működnie kell, mert az alváz azonos: pl. az ember 17. kromoszómájának szinte minden génje megtalálható az egér 11. kromoszómáján is. De hogy említsek példát a kikapcsoltra: az emberi kaszpáz-12 gén bázisvesztett, ezért nem működik. Ott van egy több ezres szekvencia, amely pár kicsavart csavar miatt rottyon van. A csimpánz kaszpáz-12-ese jó, az működik. (Ez a gén a programozott sejthalálban játszik szerepet, nagyon összetett szerepe van.) Hogy mondjak valami megfoghatót: az MYH16-al jelzett génszakasz a majmokban működik, az emberben – nem. Ez egy olyan fehérjét kódol, amely a rágóizmokban expresszálódik, segíti az izomkötegek méretnövekedését, és az állkapocsizomzat megerősödésében fontos, megkerülhetetlen a szerepe. Nyilvánvaló, hogy ennek a fehérjének a hiánya nagymértékben lecsökkentette az emberi állkapocs izomerejét és harapáserősségét.
Ezért van sokkal kevésbé majompofánk. Ez előnytelen mutációnak látszik, és ha valaki abban bízik, mekkorát tud harapni, akkor az is, de ha onnan szemléljük a kérdést, hogy ezzel megváltozott a teljes emberi koponyaszerkezet, mert az állkapocs és az agykoponya kapcsolata, ezzel megnőtt a koponya homloki része, amely lehetővé tette szép nagy homlokagy kifejlesztését, melynek segítségével az ember először kőbaltát, majd géppuskát csinált, és egyébként meg kiskéssel felvágja vagy darálóval megdarálja, amit meg kell, és a fogtechnikus meg csinál neki protkót, és onnantól sz.rik arra, mekkorát tud harapni, akkor már látjuk, hogy nem volt ezt hiba kikapcsolni. Vagy egy másik példa: a Fox P2 gén szerepe. Ez egy pontosan nem ismert mechanizmus által a hangszál-hangerősséget befolyásolja. Az eredeti majomgén hatására elképesztően magas hangerővel tud a majom ordítani, az emberi gén, ha nem is működésképtelen, de csökkent működésű. Így mi nem tudjuk berikácsolni a dzsungelt, viszont cserébe meg tudunk gyorsan hangfrekvenciát változtatni, amit népiesen úgy mondjuk, hogy tudunk beszélni. A csimpánzok fizikailag nem tudják kiejteni az emberi hangokat olyan gyors egymásutániságban, hogy stabilan összetett beszédhangokat adjanak. Érdekes, de ismert a Fox P2 defektusa – sőt, hát, pont ez alapján találták meg – egyes családok ugyanis örökletes afáziában (beszédképtelenségben) szenvednek, ahol ez a gén károsodott, pontosabban „visszakárosodott”, visszaállt a majom-eredetibe, így artikulálatlan üvöltésben nagyon jók az ezt hordozók, de azt, hogy szárnytővasaláscsapkihúzószerkezetbiztosítóhuzal, nem igen tudják kiejteni, sőt, súlyos állapotban még egy fuck off-ot se.
Genetikai anyagunk „nem kódoló” szakaszainak többsége azonban nem ilyen, hanem bonyolult szabályzó szakasz. A bacitériumoknál ez is egyszerűbb, mert ők már csak ilyen ócó kici jószágok.
A baktériumok – ugye, mindenki emlékszik rá az előző részből – kör alakú, gyűrűs DNS-sel rendelkeznek (a plazmidjaik mellett, de azok is gyűrűsek), azaz csak egy „kromoszómájuk” van, ami az ő esetükben azért idézőjeles, mert nem festhető, mivel nincs olyan fajta fehérjetokja, mint a magasabb rendű szervezetek DNS-ének. A baktérium, hogy fehérjét tudjon gyártani, ezért mRNS-t kell írni a DNS-éről, egy, a DNS polimerzához hasonló, de értelemszerűen RNS polimeráz enzimet használ. Ez egyszerre mindig csak a DNS egyik szálát másolja RNS-re. A szintézis iránya az RNS utolsó ribózának 5«-ös szénatomjáról a 3-as végű szénatomján szabad ribóz irányába megy, a leolvasás meg értelemszerűen fordítva. A DNS mindkét szála kódolhat, és mindkettő leolvasható. A gyűrű alakú DNS-en a két szálon a transzkripció egymással szemben halad. A polimeráz csak megfelelő magnéziumkoncentráció esetén hajlandó dolgozni.
AZ RNS szintáz (polimeráz) nem igényel indító láncot (aki nem tudja, miről van szó, lapozzon vissza az előző részre: a DNS másoláshoz a másoló enzimnek kell egy minta), a készült RNS pont olyan lesz, mint a komplementer DNS, eltekintve attól, hogy ahol a DNS-ben timin van, itt uracil, de a jelentése ugyanaz. De honnan tudja az a hülye RNS polimeráz, hogy mit másoljon? Onnan, hogy ez egy eléggé komplex enzim, („core”) és öt alegységből áll, amiből négy kell a konkrét DNS-ról RNS-re írási feladathoz. De az egyik alegysége,a szigma jelű, az azt csinálja, hogy megy végig a bacika DNS-én, és olyan bázisszakaszokat keres, ahová ő hidrogénkötésekkel be tud kötni. Ehhez természetesen szét kell tekerni a kettő szálat, nem szépeket mondva, mint szűzlány lábikóit, hanem némi energetikai felhasználással, hiszen csak akkor lehet a templát DNS-hez hozzáférni. Ahol a szigma beköt, egy bonyolult térszerkezeti mechanizmussal létrejön az ún. „transzkripciós buborék”, azaz egy szakaszon a DNS kinyílik, és végig tud rajta tekerni az enzim, utána összezáródik. Ezeket a szakaszokat – a hol a szigma-fehérje beköt - promoternek nevezik. A baktériumok minden transzkripcióra kerülő egysége egy promoterrel kezdődik, amely nem kódol fehérjét, az a dolga, hogy oda a polimeráz szigma-egysége bekössön. A promoter szakaszok kötéserőssége eltérő, ezért mivel véges számú polimeráz szaladgál fel-alá a baktérium DNS-én azokon a promoterken, ahol a bekötési erősség nagy, nagyobb valószínűséggel lesz polimeráz, amelyik meg kisebb, ott ritkábban. Ahogy hosszúcombú Zsuzsit is gyakrabban viszik táncba, mint baltaarcú Lujzát. Más szavakkal, a promoter erős vagy gyenge jellege határozza meg, hogy hány mRNS íródjon arról a génszakaszról, és ezért mekkora mennyiség készüljön ebből vagy abból a fehérjéből. Külső ingerekre ez annyiban változhat, hogy bizonyos külső ingerek hatására megváltozhat a lokális ionkocentráció, ezzel a promoter erőssége, és akkor ez vagy az az mRNS nem készül, vagy fokozottan készül, és megváltozik a fehérjeszintézis sebessége. Mindenesetre ez csak eléggé korlátozott reagálást tesz lehetővé a külső igényekre, ezért a bacik gyakran megdöglenek. Ezért a baktériumokban is vannak regulátor fehérjék, amelyek ezt a folyamatot módosítják, az ún. represszorok például.
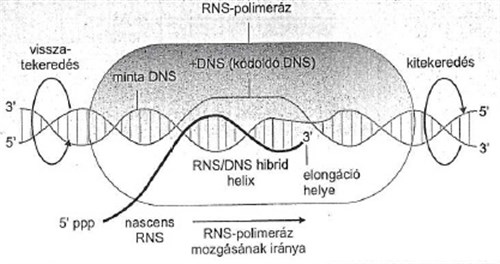
Az ún. „transzkripciós buborék” vázlata. Ábra: Ádám Veronika és munkatársai: Orvosi biokémia
Mint említettem, a baktériumok DNS-e meglehetősen tömörített. Egy-egy fehérje szintézisééért felelős DNS-szakasz a baktériumban folytonos, nem lehet több helyen kódolva, mint az eukariótákban, sőt, sokszor nincs is előttük promoter, azaz, ha valahová beköt a másolóenzim, akkor végigmegy az egész soron, mint egyfogú néger a főtt kukoricán. Jellegzetes prokarióta sajátosság – magasabb rendűekben nem fordul elő – az ún. policisztronos mRNS készülése. Az ilyen mRNS több fehérjét is kódol, mert sorban lemásoltak mindenkit, egy RNS láncon viszi el több fehérje aminosav-szekvenciáját. Mivel a baciknak nincs sejtmagja, és a folyamatok nincsenek annyira elhatárolódva, nem ritka, hogy még az RNS polimeráz szintetizálja az mRNS 3-as végét, míg az 5-ös végéről már folyik a fehérjeszintézis. Mint amikor Dzsulia néni még gyúrja a spagetti egyik végét, és a kis Dzsuzeppe már falja a másik végét.
Az mRNS-ek egyszálúak, és ugyanúgy helixesen csavart, hosszú csíkok, mint a DNS-ek, viszont van egy érdekes tulajdonságuk: a végük el van varrva, ahogy nagyanyám is beszegi a nadrág alját, hogy ne történjen felfeslés. Leginkább egy csiptetőre vagy hasonlítanak. Szerepe részben pont ez: véletlenül se történjen bázisvesztés, ne szakadjon le a vége, amíg nem kell. Ez a szerkezet annak a következménye, hogy az RNS-ek végének bázissorendje speciális. A transzkripciós egység (a gén) legvégén, a következő promoter előtt egy olyan bázissorrend van, amely oda-vissza olvasva ugyanaz, azaz úgynevezetett palidrom. Szavakban is van ilyen, pl. ha leírod, hogy „erőszakos kannak sok a szőre”, vagy, hogy „Móni fara finom”, az mindkét irányba olvasva ugyanaz a betűsorrend. Gimiben kiváló biosztanárom azt mondta, onnan lehet megjegyezni, hogy Pali bácsi, iskolánk kedvenc gondnoka, aki olyan púpos volt, hogy másodállásban a földrajzszertárban volt hegységmakett, nagyon hasonlít a dromedárra, mindkét oldalról (olyan, mint a szódásüveg: elől-hátul púpos, alul-felül spriccel). Ennek megfelelően, mikor elkészül a baktérium mRNS, a végére egy olyan szakasz kerül, amely komplementer saját magával, ezért szépen összetapad, és ez a vég már nem is kódol aminosavakat, de nem is tud, hiszen ezen a12-40 bázispárból álló szakaszon az RNS kvázi kettős lánc, azaz „nem fér be”, ezért ez a láncvég szépen lepattintja a DNS-ről, és itt van vége a szintézisnek, mikor ez felkunkorodik, az enzim tudja, hogy na, ezt most ki kell köpni, és fűzzünk be újat. Ez a vég – amely mindig 4-5 uracillal fejeződik be a csiptetés után, azaz az mRNS-nek mindig van egy apró farkincája – értelemszerűen nem kódol már fehérjét, előtte van a láncon a „szintézis állj” bázishármas, azaz a stopkodon (UAA, UAG) (erről majd a következő részben értekezünk).
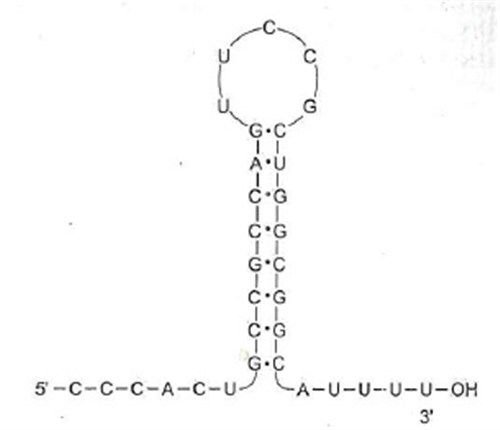
A prokarióták mRNS-ének végének speciális, hajtűszerű szekvenciája. Ábra: Ádám Veronika: Orvosi biokémia
Természetesen hasonlóan íródnak át az r (riboszóma) és a t(transzfer) RNS-esk is. Ezekből több helyen is van kód a DNS-en. Az E. coliban például a háromféle (mert a bacikna háromféle van) rRNS egy hosszú, folyamatos láncban szintetizálódik le, sőt, erre még rá van írva egy transzfer-RNS is. Ezt az elsődleges láncot aztán speciális enzimek – ribozimek, azaz nem-fehérje enzimek, hanem enzimként működő RNS-ek – szépen feldarabolják a megfelelő szakaszokra, ezt követően pedig ezek az RNS-ek még további módosulásokon is átmennek, hogy speciális munkájukat el tudják végezni.
Nekünk – többsejtű, sejtmagos állatkáknak - annyival bonyolultabb az életünk, hogy a mi szintézis-szabályzásunk jóval összetettebb, de kell is, mert sokkal több dologra kell reagálnunk, mint egy baktériumnak, és mivel lassabban osztódunk, drágák vagyunk, nem gazdaságos folyton megdöglenünk. A bacik megengedhetik maguknak, hogy halomra halnak, és csak egyes kiválogatott mutánsok szaporodnak el – egy átlagos baci 12 óra alatt tud magából kikelve megfelelő körülmények között 10 milliárd bacit csinálni, erre az emberiségnek 200 000 év kellett.
A baktériumokban a fehérjék bontása meglehetősen lassú, az mRNS-eik viszont csak pár percig „élnek”. (Ezért is nem lehet mRNS-t gazdaságosan baktériumsejttel gyártatni biotech úton.) Ezért ott az életműködések szabályzása kb. egyenlő az mRNS-ek mennyiségének szabályzásával, mert a válasz rendkívül gyors. A magasabb rendűekben az mRNS-ek élettartama ennél sokkal hosszabb, rendszerint napok, hetek - mRNS oltás kapcsán felmerül, mi van, ah ennél is több? - ezért a szabályzás más jellegű.
Először is, a magasabb rendűekben több DNS dependens RNS polimeráz van. AZ I-es típus a riboszóma-RNS-eket gyártja, az mRNS-eket a II-es, a transzfer RNS-eket, és az egyik riboszóma-RNS-t a hármas. A gyilkos galóca, mint különösen és feltűnően rohadék méreg, a II-es polimerázt gátolja alfa-amatoxinjával. Ezért minden testi sejtet el tud pusztítani, de leginkább a legaktívabban fehérjéket gyártó májsejteknek tolja be a karót a küllői közzé, ezért kell egy alapos galócapörkölt után új májat vételezni. Egyes antibiotikumok, mint pl. az aktinomicin vagy a tetrán, remekül gátolják az összes átíró enzimet. A baktériumokét jobban, ezért a baktériumok előbb fordulnak fel tőle (míg nem válnak rezisztensé) , mint az a szervezet, akiben a baktérium lakik. Vírust nem lehet antibiotikummal lecsapni, mert aki nem él (és egy virionnak sejten kívül nincs életjelensége) azt logikus módon cudar nehéz megölni. A rifampicin pedig azt is tudja, hogy a baktérium DNS-éhez kötődik, a magasabb rendűekéhez nem, mert nem tud bejutni a sejtmagba, ezért ez az antibiotikum úgy nyírja ki a baktériumokat, hogy az embernek semmit sem árt. Kivéve, ha száz kilót becsomagolnak belőle egy ládába, és a harmadik emeletről a fejére ejtik az illető embernek.
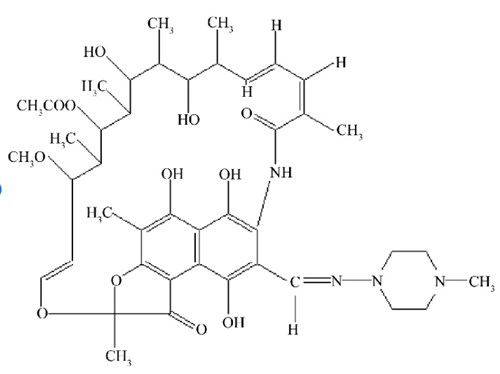
A rifampicin aszelektíven gátolja a baktériumokban az mRNS képződését, a DNS dependesn RNS polimeráz működését. Így hatékony antibiotikum
Nos az állatok, ideértve minket is, II. RNS polimeráza (emlékeznek: aki az mRNS-eket csinálja) önmagában nem tud hozzákötődni a DNS-hez. Ehhez neki segítő fehérje, ún. transzkripciós faktor kell, amely ezt mondja, hogy öcsém, itt kötsz be, és innen másolsz. A regulált génhez kapcsolódnak különböző erősítő (enhancer) és gyengítő (silencer) génszakaszok is, amelyek a fehérje kötődését módosíthatják, és ún. koaktivátor fehérjék is. Vannak a sejtekben olyan fehérjék, amelyek különböző hatásokra ezeknek a fehérjéknek az aktivitását önmagukban befolyásolják,így bármely külső körülmény hatására változik, hogy mely génről készül mRNS, melyikről nem. A DNS-t speciális fehérjék – cinktartalmúak, illetve magas leucintartalmúak – össze is tudják ragasztani, hogy innen, öcsém, mánpedig« nem másolsz. Azt gondolom, nem kell bizonygatni, hogy vannak a rendszerben olyan transzaktivátor fehérjék, amelyek sejten belüli hormonreceptorok, azaz akkor válnak aktívvá, ha kapnak egy hormonmolekulát, hogy hé, ébresztő, neked most le kell gyártatni egy fehérjét, nyomás, dolgozni. A megfelelő hormon kötődése az adott receptorhoz átalakítja, aktiválja a receptort, amely ezt követően fogja magát, rámászik a DNS-re, azon belül megkeresi az adott génhez tartozó ún. reszponzív (felelős) szakaszt, és oda kötődve segíti, de egyes esetekben meg éppen hogy gátolja az RNS polimeráz működését. Ponti ilyenek a pajzsmirigyhormon receporai, az A és D-vitamin receptorok, és egyébként a szteroidhormonok recepotrai is. Ártatlan festőművész Ricsike bekapja a stanazolt, mikor éppen nem kokót kap be, vagy a ribanca nem neki kapja be, elindul a stanazol, megérkezik az izomsejtbe, és beköt abba a receptorba is, ahová a tesztoszteron szokott, csak ő sokkal erősebben és tartósabban, és megkéri szépen a polimerázt, hogy kezdjen mRNS-t szintetizálni izomfehérje-gyártáshoz. Ha én lennék a bíró, lennék akkora köcsög, hogy M. Richárdra rászabnám, hogy majd 25 év múlva akkor szabadulhat feltételesen, ha felmondja Tóth Miklós Anabolikus-androgén szteroidok hatása, hatásmechanizmus és felhasználása (Medicina, ill. SOTE kiadó, eredetiben 1990, legutolsó kiadás 2012) című tankönyvét oda-vissza. (Meg az általam írt stimuláns hatású kábítószerek, amefetamin és kokain használata a hadviselésben c. disszertációt bónuszként.) Azt hiszem, 25 év is kevés lenne neki hozzá.
Mint az előző rész elején említettem volt, az ilyen fehérjék ki-be kapcsolgatása általában foszforilizációval történik, mert azt könnyen és hatékonyan elvégzi pár segédenzim, és ennek hatására az ilyen fehérjék pikk-pakk tudnak térszerkezetet váltani, és csinálni, amit kell. A foszfoilizálás olyan a biokémiában, mint az elektromosságban a billenőkapcsoló, csak kisebb, és halkabban kattan. Hogy egy extrém szabályzási példát is ideidézzek, van egy tumorszupresszor-presszor, az ún. Rb fehérje. (Igazság szerint retinoblasztóma-fehérje kéne hogy legyen, de ezt még egy biokémikus se szereti kimondani.) Ez az Rb fehérje komplexet képez egy másik fehérjével, ami egy transzkripciós faktor, és az a dolga, hogy azt a génszakaszt aktiválja, amely a sejtosztódás egyik fázisában szükséges fehérjéket kódolja. Amíg az Rb fehérje hozzá van csókolózva Valentin-nap alkalmából ehhez a fehérjéhez, addig az nem mozdul. A sejtosztódás ún. G1 fázisában előugrik egy enzim, ez jól megfoszforilizálja az Rb fehérjét, ez ekkor megijed, elengedi a transzkripciós fehérjét, az felszabadul, és a sejtosztódás végbemehet. Ha ez az Rb fehérje nem jó, akkor a szabadon lófráló transzkripciós fehérje unos-untalan sejtosztódást indukál, és kész a rák.
Az eukarióták mRNS-e kb. úgy készül, mint a baciké, de mikor leválik a gyártóenzimről, még nem kész, még nem üzemképes. Ez a nyers mRNS, amit heteronukleáris RNS-nek is hívnak erre ráérő emberek, még tartalmazza a DNS láncról készült teljes másolatot, nemcsak fehérjét kódoló bázisokat, hanem a nem kódoló, ún. intron szakaszokat is. Az mRNS-nek „meg kell érnie”, mint a milfnek, az elülső, ahogy mondjuk, az 5«-ös végre kerül egy „sapka”. Persze, nem egy usanka, hanem egy módosult nukleotid, egy metil-guanin, ráadásul pirofoszfát-kötéssel, az utána következő két láncvégi nukleotid ribózát pedig metilálja egy enzim. Így le van forrasztva a vége, kóbor hülyegyerek enzimek nem szedik csak úgy szét. A másik végére egy másik enzim ráépít egy ún. poli-A-farkat, amely egy eléggé hosszú, speciális szekvenciát, amivel majd az mRNS bekötődik a munkahelyére. Ezt követően kivagdalja belőle egy másik RNS, a kevéssé ismert sn RNS a nem kellő szekvenciákat, azaz az intronokat.
Ez mondhatni egyszerűen hangzik, de ugye, itt sem tévedhetnek az enzimek egyetlen nukleotidot se. Az intronoknak megfelelő szakaszok kimetszésében három kitüntetett nukleoidszekvencia lényegesaz ún. 5-ös splice-hely (az intronnak megfelelő szakasz elülső, azaz 5-ös végén) értelemszerűen a 3-as splice (az intronszakasz 3-as végén, tehát a végén) és az ún. elágazódási hely, ami 20-50 nukleotidnyira van az intron 3-as végétől. Ha mind a három hely megvan – annyiszor, ahány intron van a nyers RNS-en, ez molekulánként szélsőséges esetben több száz is lehet. Kivétel nélkül minden gerinces, továbbá a politikusok, ügyészek, ügyvédek, rendőrök, médiacelebek és parkolóőrök mRNS-eiben is az 5-ös végen GU, a 3-as végen AG található, a többivel a kimetsző enzim, amelyet viccen kívül, nem hivatalosan sakternak is hívnak, nem foglalkozik. A kimetszés (splicing) úgy történik, hogy az ún. kitüntetett helyen (azaz, mint mondottam, a vége előtt 20-50 nukleotidnyira) egy adenin van bázisként, ennek a 2-es hidroxilcsoportja összebarátkozik az 5-ös vég nukleotidjával, és létesít annak foszfátjával egy foszfátdiészterkötést. Más szavakkal, létrejön itt egy hurok, majd ekkor az 5-ös vég nukleotidjának 3-as hidroxilcsoportja szabaddá válik, és hátranyúl a másik vég foszfátkötéséhez, és szépen kiharapja saját magát a molekulából. Ja, és mindez az ateisták szerint csak úgy magától lett, minden, az anyagon túlmutató tervezés, akarat nélkül.
Azaz, a „nyers”, pl. PCR sokszorozással nyert mRNS-ek emberben (és más állatban) nem hatnak. Ezeket okosan kell tervezni, és ha azt akarjuk, hogy stabilitásuk megfelelő legyen, igen speciális körülmények között kell gyártani.
Namármost, azt hiszem, ennyiből látszik, hogy mRNS-t készíteni nem olyan egyszerű dolog, és akik ilyen molekulákat gyártanak szintetikusan, azok tudják, mit csinálnak, nem szarral gurigáznak, és mindenki számára állíthatom, ahogy Bayer Zsoca is mondta, hogy tessék megbízni a tudományban!
Megjegyzés: természetesen abban a tudományban, amely egyébként ötszáz éve szentül hirdette, hogy a Nap kering a Föld körül, négyszáz éve szentül hirdette, hogy hogy a betegségeket miazma okozza, háromszáz éve szentül hirdette, hogy az ércből úgy lesz fém, hogy eltávozik belőle a flogiszton, százötven éve szentül hirdette, hogy levegőnél nehezebb repülő szerkezet nem építhető, ötven éve szentül hirdette, hogy a protonok és az elektronok aprócska golyók, és három éve szentül hirdette, hogy vírus okozta halálos világjárvány csak összeesküvés-elméletekben és hollywoodi filmekben bukkanhat elő, mert a hivatalos tudomány természetesen soha nem téved. Ebben a tudományban tessék maradéktalanul megbízni. Ja, meg abban a tudományban, amely elmagyarázza önöknek, hogy az mRNS vakcinát -80 C fokon kell tárolni, mert az mRNS rendkívül bomlékony, és ha csúnyán néznek rá, menten vége, de a koronavírus RNS-ét meg hopp, napok, hetek múltán is pontosan kimutatja – a rohadó szennyvízből, százezernyi más élőlény mellől.
De muszáj a vírusokra való rátérés előtt pár szót ejteni arról is, hogy miképpen lesz az mRNS-ből – pontosabban a belőle tárolt információból - fehérje. Ígérem, tömör lesz.
Felhasznált irodalom:
Ádám Veronika és munkatársai: Orvosi Biokémia, 2010
P. Karlson: Biokémia, Medicina, 1973
Francis Collins: Isten ábécéje, Akadémia kiadó, 2020
Alföldy Zoltán – Nász Ferenc: Mikrobiológia, Medicina, 1974
Balázs Lóránt: A kémia története, Nemzeti Tankönyvkiadó, 1996
Knoll József: Gyógyszertan I-II, Medicina, 1983